В статье рассмотрены способы применения костного цемента на основе полиметилметакрилата импрегнированного антибиотиками для лечения больных хроническим посттравматическим остеомиелитом костей конечностей. Представлены клинические случаи применения костного цемента в комбинации с антибактериальными препаратами в качестве антимикробных спейсеров и пластического материала для заполнения остаточных постостеомиелитических полостей.
Костный цемент импрегнированный антибиотиками применен при лечении 22 больных хроническим остеомиелитом. В качестве антибактериальных препаратов для добавления в костный цемент использовали жидкий раствор гентамицина и порошок ванкомицина. У 9 больных костный цемент импрегнированный антибиотиками применен для пластики остаточной постостеомиелитической полости, у 10 больных в качестве антимикробных спейсеров, у трех больных для формирования активного антибактериального покрытия блокируемых интрамедуллярных штифтов. По результатам исследований непосредственные благоприятные результаты лечения отмечены у 81,8% больных, ближайшие хорошие результаты лечения отмечены у 94,4% больных хроническим остеомиелитом костей конечностей.
3D ЧЕРЕП ЧЕЛОВЕКА | Все Кости | Названия на Латыни, Расположение и Особенности | Анатомия | Cranium

костный цемент импрегнированный антибиотиками
хронический остеомиелит
1. Амирасланов Ю.А. Современные принципы хирургического лечения хронического остеомиелита (лекция) / Ю.А. Амирасланов, А.М. Светухин, И.В. Борисов // Инфекции в хирургии. – 2004. – Т.2. – №1. – С. 8-13.
2. Ефименко Н.А. Профилактика инфекций области хирургического вмешательства в травматологии и ортопедии: использование антибиотиков в костном цементе // Инфекции в хирургии. – 2009. – №2. – С. 15-27.
3. Иванов П.А. Применение интрамедуллярных блокируемых штифтов с активным антибактериальным покрытием при лечении тяжелых открытых переломов и их осложнений // Вестник травматологии и ортопедии им. Н.Н. Приорова. – 2009. – №1. – С. 13-18.
4. Куропаткин Г.В. Костный цемент в травматологии и ортопедии / Г.В. Куропаткин. – Самара: «Издательство Самара», «БМВ и К», 2006г. – 48с.
5. Мамаева Е.Г. Цитопротекторные препараты для коррекции токсического действия акрилового костного цемента (экспериментальное исследование) // Вестник травматологии и ортопедии им. Н.Н. Приорова. – 2002. – № 1 – С.58-62
6. Raghuram T. Nonunions and Segmental Bone Defects Antibiotic Cement-Coated Nails for the Treatment of Infected / T. Raghuram, J. D. Conway // The Journal of Bone Joint Surgery. – 1976. – Vol 50-А, №1. – Р. 76-81.
8. Jon T. In Vitro Evaluation of Antibiotic Diffusion from Antibiotic Impregnated Biodegradable Beads and Polymethylmethacrylate Beads / J.T. Mader, J. Calhoun, J. Cobos // Antimicrobial agents and chemotherapy. – 1997. – Vol 41, №2. – P. 415–418.
9. Jaeblon Т. Polymethylmethacrylate: Properties and Contemporary Uses in Orthopaedics / T. Jaeblon //Journal of the American Academy of Orthopaedic Surgeons. – 2010. – Vol 18, №5. – Р. 297-305.
Что такое мед?
10. Wininger D. Antibiotic-Impregnated Cement and Beads for Orthopedic Infections / David A. Wininger and Robert J. Fass // Antimicrobial agents and chemotherapy. – 1996. – Vol 40, №12. – Р. 2675–2679.
Лечение хронического остеомиелита костей конечностей, частота развития которого, несмотря на применение самых современных методов диагностики, профилактики и лечения, не имеет тенденции к снижению, является одной из наиболее трудно разрешимых проблем в хирургии и травматологии.
Основой лечения хронического остеомиелита является радикальная хирургическая санация очага инфекции и подавление в нем активности бактериальной флоры, и при необходимости проведение реконструктивно-восстановительного лечения [1].
Одним из методов лечения больных хроническим остеомиелитом костей конечностей, является применение костного цемента на основе полиметилметакрилата импрегнированного антибиотиками [4,6-10]. Положительным качеством применения костного цемента импрегнированного антибиотиками является высвобождение антибиотиков в течение длительного периода времени [8-10]. Отрицательным моментом применения костного цемента является токсическое воздействие мономера метилметакрилата, которое может привести к серьезным интра- и послеоперационным осложнениям [5].
Существует ряд методик использования костного цемента, применяющихся в гнойной остеологии.
Одним из способов является замещение остаточной постостеомиелитической полости, возникающей после некрсеквестрэктомии, костным цементом импрегнированным антибиотиком. Входящий в состав цемента антибиотик способствует купированию инфекционно-воспалительного процесса благодаря созданию высокой концентрации антибиотика местно [3,4].
Другим способом применения костного цемента является изготовление спейсеров. Спейсеры активно используются при лечении больных с глубокой параэндопротезной инфекцией [2,4,8]. При лечении больных хроническим остеомиелитом костей конечностей используют различные варианты спейсеров: «цементные» бусы, блоковидный спейсер, армированный интрамедуллярный спейсер [4,10]. Также, костный цемент с антибиотиком применяется для профилактики инфекции области хирургического вмешательства при эндопротезировании крупных суставов [2,4], для профилактики и лечения посттравматических и послеоперационных инфекционных осложнений опорно-двигательного аппарата. В данном случае костный цемент применяется для изготовления активного антибактериального покрытия интрамедуллярных штифтов, которые в последующем используют для проведения блокируемого интрамедуллярного остеосинтеза [3,6].
Цель исследования. Улучшить результаты лечения больных хроническим остеомиелитом костей конечностей путем применения костного цемента в комбинации с антибиотиками.
Материалы и методы. Проведен анализ лечения 22 больных хроническим остеомиелитом (мужчин – 18, женщин – 4), при лечении которых применен костный цемент импрегнированный антибиотиками. Средний возраст больных составил 47,5±15,9 лет (min – 18, max – 74).
У всех больных диагностирован хронический посттравматический остеомиелит костей конечностей, из них у 9 хронический послеоперационный остеомиелит.
По локализации пораженного сегмента больные разделены: плечо – 2, стопа – 4, голень – 14, бедро – 2.
Всем больным проведена оперативная санация очага хронической инфекции. Удаление металлофиксатора считаем обязательным, иначе сформировавшаяся на поверхности абиогенного субстрата микробная биопленка будет способствовать в дальнейшем рецидиву инфекционного процесса. После проведения основного санирующего этапа операции пятерым больным в послеоперационную рану имплантирован антимикробный блоковидный спейсер, пятерым больным с медуллярной формой остеомиелитического процесса длинной трубчатой кости имплантирован армированный интрамедуллярный спейсер на спице Киршнера, 9 больным проведена «пломбировка» остаточной постостеомиелитической полости. У трех больных с дефект-псевдоартрозом длинной трубчатой кости выполнен блокируемый интрамедуллярный остеосинтез, при этом костный цемент импрегнированный антибиотиками использован для изготовления антибактериального покрытия блокируемого интрамедуллярного штифта.
В качестве антибактериального химиопрепарата к стандартной упаковке костного цемента весом 40 грамм добавляли раствор гентамицина 480 мг и порошок ванкомицина 3 грамма. Порошкообразный антибиотик добавляли в порошок полимера и тщательно перемешивали, а жидкий раствор антибиотика добавляли в раствор мономера, после чего производилось смешивание компонентов. Необходимо отметить, что при добавлении антибиотиков в костный цемент происходит нарушение процессов его полимеризации, в результате чего работа с готовой композицией должна проводится как можно быстрее до ее затвердевания. В качестве формы для изготовления интрамедуллярных спейсеров и цементной мантии интрамедуллярных штифтов использовали стерильные силиконовые трубки различного диаметра. После затвердения цементной массы трубка разрезается и удаляется, острые края цемента срезаются и затачиваются.
Дополнительно проводили дренирование послеоперационной раны по Редону или приточно-аспирационное дренирование. Одному больному, после купирования инфекционного процесса и удаления антимикробного спейсера, выполнили компрессионный остеосинтез костей голени по Г.А. Илизарову.
Результаты и обсуждение
При оценке непосредственных результатов лечения использовали критерии М.В. Гринева (1977), по данным которого основным показателем являлся характер заживления послеоперационной раны при выписке больного из стационара. Хорошим считали результат, при котором рана заживала первичным натяжением; удовлетворительным, если рана заживала вторичным натяжением; неудовлетворительным, если развивалось нагноение. При сравнении результатов лечения исследуемых групп хорошие и удовлетворительные результаты рассматривались как благоприятные исходы, а плохие − как неблагоприятные результаты лечения.
У пациентов, у которых получен хороший и удовлетворительный непосредственный результат лечения через один год после лечения проводили повторный осмотр и обследование, оценивая, таким образом, ближайшие результаты. При оценке ближайших результатов лечения использовали критерии В.К. Гостищева (1999). Хорошим считали результат, если в течение года после лечения у пациента отсутствовали клинические признаки обострения инфекционно-воспалительного процесса, а при рентгенографии (при необходимости компьютерной томографии) не выявлено признаков рецидива остеомиелитического процесса в области проведенного оперативного вмешательства. Плохим считали результат, если произошло обострение остеомиелитического процесса, а при рентгенографии (при необходимости компьютерной томографии) выявлены очаги остеомиелитического поражения в зоне проведенного оперативного вмешательства.
Благоприятный непосредственный результат отмечен у 18 (81,8%) больных. Хороший ближайший результат при использовании костного цемента импрегнированного антибиотиками получен у 17 (94,4%) больных.
Приводим клинические примеры (рис. 1-4)
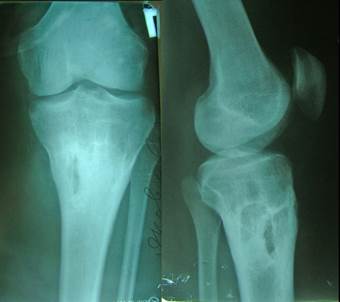
Рисунок 1. Клинический пример. Больной Я, 32 года. Хронический посттравматический остеомиелит правой б/берцовой кости (рентгенограммы до операции). Остеомиелитическая полость проксимального отдела большеберцовой кости
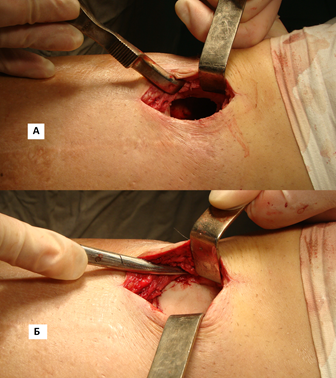
Рисунок 2. Постостеомиелитическая полость до (а) и после (б) заполнения костным цементом (интраоперационное фото)
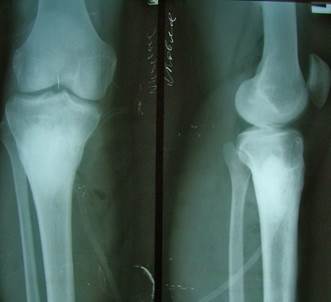
Рисунок 3. Больной Я. Рентгенограммы после операции
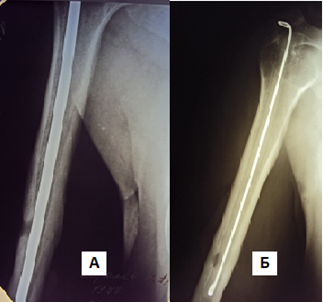
Рисунок 4. Клинический пример №2. Больной К., 35 лет. Диагноз: Хронический послеоперационный остеомиелит правой плечевой кости. Рентгенограммы до (а) и после (б) оперативного лечения (удаление штифта, остеонекрсеквестрэктомия, имплантация интрамедуллярного армированного спейсера)
1. Костный цемент импрегнированный антибиотиком позволяет замещать остаточные постостеомиелитические полости, способствуя купированию инфекционного процесса.
2. Для длительной местной антибактериальной терапии у больных с медуллярной формой хронического остеомиелита после некрсеквестрэктомии целесообразно имплантировать в костномозговой канал пораженной трубчатой кости, армированный интрамедуллярный антимикробный спейсер.
Рецензенты:
Смолькина А.В., д.м.н., профессор кафедры госпитальной хирургии, анестезиологии, реаниматологии, урологии, травматологии и ортопедии Института медицины, экологии и физической культуры ФГБОУ ВПО «Ульяновский государственный университет», г.Ульяновск.
Островский В.К., д.м.н., профессор, заведующий кафедрой общей и оперативной хирургии с топографической анатомией и курсом стоматологии Института медицины, экологии и физической культуры ФГБОУ ВПО «Ульяновский государственный университет», г.Ульяновск.
Источник: science-education.ru
Название меда от костей
В интервью с профессором О.А. Громовой освещены вопросы лечения и профилактики остеопороза
Для цитирования. Остеотропные минералы: роль в восстановлении и поддержании костной ткани. Интервью с О.А. Громовой // РМЖ. 2015. No 25.
С. 1496–1498.
– Какие лабораторные и инструментальные методы используются для диагностики остеопороза?
– Важно определять минеральную плотность кости (МПК), оценивать Т-критерий. Нормальными показателями МПК считаются показатели Т-критерия от +2,5 до −1. Значения Т-критерия от −1 до −2,5 стандартного отклонения соответствуют остеопении, −2,5 стандартного отклонения и ниже – остеопорозу. О тяжелом остеопорозе свидетельствуют −2,5 стандартного отклонения и ниже и наличие в анамнезе одного и более переломов.
Положительная динамика устанавливается при выявлении прироста МПК более чем 2–3% за год при отсутствии новых переломов.
Стабильным можно считать состояние, когда нет новых переломов костей, не выявляется прирост МПК или ее снижение (±2%).
Прогрессирование остеопороза (отрицательная динамика) определяется при возникновении новых переломов за период лечения и/или при снижении МПК более чем на 3% за год.
На обычной рентгенограмме важным признаком остеопоротических изменений является особая геометрия проксимального отдела бедренной кости – он имеет больший шеечно-диафизарный угол, более длинную ось шейки бедра.
Важно определить в крови уровень паратгормона (ПТГ) – одного из основных регуляторов кальциевого обмена в организме (диапазон нормы очень широкий – 0,127–530 пмоль/л). Следует помнить, что ПТГ характеризуется циркадным ритмом с максимальными значениями в 14–16 часов и снижением до базального уровня в 8 часов.
Необходимо определить и уровень остеокальцина, особенно для диагностики менопаузального остеопороза. Норма для женщин старше 50 лет составляет 14–46 нг/мл. При остеопорозе этот показатель повышается. Для оценки степени разрушения сшивок коллагена используют тест на дезоксипиридинолин в моче. Диапазон нормы составляет 7–2400 нмоль/л.
Поскольку конечный результат мочи выдается в пересчете на 1 ммоль креатинина мочи, предел указания точных цифровых значений расчетного показателя может варьировать в зависимости от уровня креатинина в пробе. Если у пациента клиренс креатинина менее 65 мл/мин, а клубочковая фильтрация менее 29 мл/мин/1,73 м2, это очень важные для врача данные, свидетельствующие в пользу диагноза остеопороза.
Следует оценить в крови уровни кальция (общий кальций в крови: до 60 лет норма – 2,1–2,55 ммоль/л, старше 60 лет – 2,2–2,55 ммоль/л), фосфора (для женщин старше 60 лет норма – 0,90–1,32 ммоль/л, мужчин старше 60 лет – 0,74–1,2 ммоль/л, магния (при этом в пользу повышения риска диагноза «остеопороз» свидетельствуют значения магния в плазме крови менее 0,82 ммоль/л (норма – 0,81–1,26 ммоль/л), а в эритроцитах – менее 1,65 ммоль/л (норма – 1,65–2,65 ммоль/л).
Очень важно оценить уровень фолатов и гомоцистеина в плазме крови. Если уровень фолатов понижен (норма – 5,3–14,4 нг/мл), а гомоцистеин выше 15 мкмоль/л, это неблагоприятный показатель, свидетельствующий об увеличении и риска, и тяжести остеопороза. Необходимо проводить тест на аномалии рецептора к витамину D, например, 7014A-VDR.
– Каковы современные направления терапии остеопороза?
– Это коррекция дефицита витамина D, кальция, магния, фосфора, достаточная двигательная активность (плавание, ходьба), изменение диеты (обилие растительных волокон, свежих овощей, нежирного качественного молока, твердого сыра и, конечно же, рыбы!). Создание безопасной среды проживания (исключающей падения).
Лекарственное направление лечения представлено препаратами с уровнем доказательности класса А: бисфосфонаты (алендронат, ризедронат, ибандронат), золедроновая кислота. Их применение всегда требует дотации макро- и микроэлементов (кальция, фосфора, магния, цинка, марганца, меди, бора), необходимых для строения коллагена кости и насыщения потребностей в реконструкции кости остеобластами.
– Какие минералы относятся к остеотропным (остеогенным) и почему?
– Важность кальция, фосфора и витамина D для целостности костей неоспорима. Рецептор витамина D, подобно эстрогеновым рецепторам, является фактором транскрипции, который, в частности, регулирует экспрессию белков, вовлеченных в гомеостаз кальция и фосфора. В то же время проводимые в течение последнего десятилетия исследования показали, как уже упоминалось, что для поддержания структуры костной ткани также необходимы витамины A, C, E, K и микроэлементы медь, марганец, цинк, стронций, магний, железо и бор.
«Остеогенность» или «остеотропность» микронутриента подразумевает его участие в механизмах роста / репарации костной ткани. Центральным механизмом ее репарации является формирование костного матрикса – структурной основы соединительной ткани, состоящей из «гелеобразного» вещества на основе гиалуронана, коллагеновых и эластиновых волокон и, собственно, самих клеток – остеоцитов.
Костный матрикс, который является основой для усвоения кальция скелетом, на 90% состоит из коллагена 1-го типа. В активную фазу репарации кости отмечается повышение синтеза коллагена 3-го типа. Поскольку синтез одного только коллагена (не говоря о других типах биополимеров в составе кости) зависит от обеспеченности организма рядом остеогенных микронутриентов (витамина D3, кальция, цинка, марганца, бора, меди, магния, железа), то и время репаративного остеогистогенеза после повреждений также существенно зависит от этих и других остеогенных микронутриентов. Под «остеогенностью» микронутриента в данном случае понимается невозможность протекания нормального процесса восстановления костной ткани на фоне дефицита этого микронутриента. Каждый из таких «остеогенных» микронутриентов характеризуется уникальными механизмами воздействия на рост костной ткани: у магния – одни механизмы, у бора – совершенно другие.
Поэтому при профилактике и лечении остеопороза, остеопении и рахита следует учитывать не только обеспеченность кальцием и витамином D, но и другие факторы питания. Например, современные исследования указали на взаимосвязь между нервной анорексией, потерей костной массы и повышением риска переломов вследствие остеопороза. Обеспеченность такими питательными веществами, как магний, калий, витамины B12 и К также способствует уменьшению риска переломов за счет улучшения костной микроархитектуры и увеличения минеральной плотности костной ткани.
– В чем опасность нарушения соотношения Mg:Ca для минерального обмена костной ткани?
– При хроническом дефиците магния нарушается важнейший аспект минерального обмена костной ткани – соотношение Mg:Ca. При снижении соотношения Mg:Ca обменные процессы в кости замедленны, быстрее депонируются токсичные металлы (прежде всего кадмий и свинец), постепенно ухудшается функция сустава, уменьшается объем движений, происходит деформация суставов и позвоночника. Эпидемиологические исследования частоты остеопороза в различных странах показали: чем более высокое значение соотношения Mg:Ca в питании, тем ниже встречаемость остеопороза.
Две трети магния нашего организма накоплено в костной ткани. Дефицит магния способствует потере костной массы. Недостаток магния в экспериментальной диете в течение всего двух недель приводил к снижению объема кости, степени и скорости минерализации костной поверхности даже на фоне потребления достаточного количества кальция.
Магний регулирует распределение кальция, воздействуя на стимулируемую веществом P выработку провоспалительных цитокинов, секрецию паратгормона и уровней активной формы витамина D. Значение дефицита магния в нарушении структуры продолжает уточняться. Некоторые эффекты магниевого дефицита в настоящее время широко признаны – например, угнетение магнием секреции ПТГ. Другие, такие как воздействие магния на сигнальные каскады ростовых факторов, остаются практически вне зоны внимания исследователей.
– Как давно ведется подробное изучение роли бора в метаболизме костной ткани? Какие основные последствия дефицита бора были описаны?
– Ультрамикроэлемент бор играет важную роль в метаболизме костной ткани. Ежедневное потребление бора в разных странах колеблется от 0,3 до 41 мг/сут; источником бора являются фрукты, овощи, орехи и бобовые. При дефиците бора, даже при достаточном содержании кальция в пище, отмечается снижение прочности кости.
И наоборот, добавление бора в пищу способствовало повышению прочности костной ткани. Обнаружена жизненная необходимость микродоз бора на примере влияния на обмен кальция, фосфора и особенно магния. Бор регулирует активность ПТГ. С фармакологической точки зрения, препараты бора характеризуются гиполипидемическим, противовоспалительным, антионкологическим эффектами. Дефицит бора стимулирует развитие таких состояний, как анемия, остео-, ревматоидный артрит, когнитивная дисфункция, остеопороз, мочекаменная болезнь и нарушение обмена половых гормонов.
– Расскажите, пожалуйста, подробнее о роли марганца, железа и меди в процессах восстановления костной ткани.
– Помимо того, что железо необходимо для поддержания достаточной обеспеченности тканей кислородом, этот микроэлемент также участвует в метаболизме коллагена – основного структурного белка всех видов соединительной ткани, в том числе костной ткани. Хронический дефицит железа в эксперименте приводит к задержке созревания коллагена в бедренной кости и к нарушениям фосфорно-кальциевого метаболизма. Железодефицитная анемия способствует нарушению минерализации и увеличению резорбции кости, значительному повышению риска остеопороза и переломов.
Медь, как и железо, участвует в модификации определенных лизиновых остатков коллагена и эластина, что имеет важное значение для формирования коллагеновых и эластиновых фибрилл. Одним из факторов, способствующих потере костной массы, являются субклинические дефициты цинка и меди, возникающие вследствие уменьшенного потребления или нарушений всасывания этих микроэлементов в организме. Цинк и медь – принципиально важные кофакторы ферментов, участвующих в синтезе различных молекулярных компонентов матрикса костной ткани. В частности, медь, являясь кофактором фермента лизилоксидазы, имеет важное значение для формирования внутри- и межмолекулярных поперечных «сшивок» между нитями коллагена. Недостаток меди у человека и животных связан с нарушениями роста, остеогенеза и хрупкостью костей, что во многом обусловлено недостаточным количеством этих поперечных «сшивок».
Марганец (Mn) – эссенциальный микроэлемент и кофактор более 200 белков, участвующих в таких разнообразных процессах, как кроветворение, иммунитет, энергетический метаболизм и метаболизм соединительной ткани. Исследования влияния марганца на развитие и структуру соединительной ткани проводятся с первой половины ХХ века; последствия дефицита марганца включают нарушения образования хрящевой ткани, аномалии развития скелета. Долгосрочный дефицит марганца и меди в диете снижает минерализацию в сочетании с увеличением резорбции кости. Этот эффект осуществляется за счет падения активности Mn-зависимых ферментов, принимающих участие в синтезе глюкозаминогликанов и других углеводных компонентов протеогликанов. Хронический сочетанный дефицит марганца и меди также приводит к снижению активности строящих кость остеобластов, увеличению резорбции костного матрикса и, следовательно, уменьшению плотности и массы костей.
– Восполнение запаса каких витаминов следует отслеживать в комплексной терапии остеопороза?
– Витамин D является одним из основных регуляторов кальций-фосфорного метаболизма. Поэтому для своевременной диагностики и оценки динамики лечения важно определять концентрацию 25-гидроксивитамина D (25-(ОН)-D) в плазме крови. Уровни витамина 25-(ОН)-D в плазме крови менее 10 нг/мл соответствуют глубокому дефициту и авитаминозу, 10–20 нг/мл – дефициту витамина D, 20–30 нг/мл – недостаточности витамина D, более 30 нг/мл – нормальному содержанию витамина D. В отличие от указанной нижней границы нормы (30 нг/мл) верхняя граница нормы четко не установлена, так что за верхнюю границу диапазона нормы условно принимаются значения в диапазоне 80–100 нг/мл. Опубликованные ранее результаты клинических исследований позволяют предполагать, что до появления каких-либо токсических эффектов (например, гиперкальциемии) уровни 25-(ОН)-D в крови должны превысить 150 нг/мл. Более точное определение верхней границы диапазона нормы требует дополнительного накопления соответствующих клинических данных.
Для поддержания структуры костной ткани также необходимы витамины A, C, E, K, витамины группы В. Витамины В6 (пиридоксин), В9 (фолаты) и В12 (цианокобаламин) способствуют нормализации фолатного метаболизма и снижению уровней гомоцистеина плазмы крови (ведь более высокие уровни гомоцистеина ассоциированы с повышенными хрупкостью костей и частотой переломов, в том числе переломов бедра у пожилых). Риск остеопороза также повышается на фоне дефицита витамина В12. Фолат- и витамин-В12-зависимая пернициозная анемия также является значимым фактором риска развития остеопороза.
Более низкое потребление витамина С связано с более быстрыми темпами потери костной массы, а более высокое потребление витамина С – с меньшим количеством переломов. Высокое потребление витамина С в пожилом возрасте (более 300 мг/сут) ассоциировано со значительно меньшей потерей костной массы по сравнению с более низким потреблением витамина.
– Давайте подведем итог: почему для полноценного восстановления костной ткани важно одномоментное назначение не только кальция и витамина D, но и остеотропных минералов?
– Возможности полного восполнения дефицитов микроэлементов, необходимых для функционирования костной ткани, существенно расширяются при использовании специальных микронутриентных препаратов. Поддержанию здоровья костной системы способствуют такие микроэлементы, как магний, железо, медь, марганец, кремний, стронций, бор и ряд других микронутриентов: витамины В6, В9 (фолаты), В12, С, К, каротиноиды, флавоноиды, омега-3-полиненасыщенные жирные кислоты (рис. 1).
Источник: www.rmj.ru
Название меда от костей
Воронежская государственная медицинская академия им. Н.Н. Бурденко
Кафедра судебной медицины и правоведения Воронежского государственного медицинского университета им. Н.Н. Бурденко Минздрава России, Воронеж, Россия 394036

Судебно-медицинская оценка переломов длинных трубчатых костей при падении с высоты
Подробнее об авторах
Скачать PDF
Связаться с автором
Оглавление
Бахметьев В.И., Бежкинева А.Р. Судебно-медицинская оценка переломов длинных трубчатых костей при падении с высоты. Судебно-медицинская экспертиза. 2019;62(6):32‑35.
Bakhmet’ev VI, Bezhkineva AR. Forensic medical assessment of fractures of long tubular bones caused by fall from height. Sudebno-Meditsinskaya Ekspertisa. 2019;62(6):32‑35. (In Russ.)
https://doi.org/10.17116/sudmed20196206132

Читать метаданные
При исследовании трупов в случаях падения с высоты интерпретация множественных признаков повреждений является обременительной, особенно в вопросах диагностики механизма образования различного вида повреждений при установлении обстоятельств причинения травмы. Цель исследования — разработка экспертно-диагностических критериев для установления механизмов переломов длинных трубчатых костей при падении с высоты на основе анализа морфологии разрушений и информационных технологий. Построены прогностические модели, позволяющие по разработанным экспертно-диагностическим критериям повреждений длинных трубчатых костей прогнозировать механизмы формирования повреждений в случаях кататравмы. Использование морфологических критериев переломов с применением метода линейного регрессионного анализа позволяет достоверно дифференцировать различные варианты приземления тела человека и диапазоны высоты падения.
Воронежская государственная медицинская академия им. Н.Н. Бурденко
Кафедра судебной медицины и правоведения Воронежского государственного медицинского университета им. Н.Н. Бурденко Минздрава России, Воронеж, Россия 394036
По оценкам ВОЗ, ежегодно происходит 646 000 падений с высоты со смертельным исходом, что делает кататравму по значимости второй после дорожно-транспортной травмы среди причин смерти от механических факторов [1—4]. Определенные успехи достигнуты судебно-медицинской травматологией в установлении механизмов образования повреждений при травме тупыми предметами. Остается незавершенной методика определения варианта приземления и высоты падения при кататравме.
Переломы длинных трубчатых костей составляют значительную долю в структуре травмы от падения с высоты — примерно 48—80% от общего числа повреждений опорно-двигательного аппарата. Факт важности корректной и объективной диагностики морфологии повреждений длинных трубчатых костей при установлении условий травмирования подтверждается рядом авторов [5—10]. Исследования позволяют с высокой степенью достоверности определить вид внешнего воздействия в различных экспертных ситуациях, однако не содержат подробного анализа переломов длинных трубчатых костей в зависимости от варианта приземления тела человека и высоты падения.
Имеется существенная необходимость разработки комплексных методов диагностики механизмов переломов длинных трубчатых костей в результате кататравмы.
Цель работы — разработка экспертно-диагностических критериев для установления механизмов переломов длинных трубчатых костей при падении с высоты на основе анализа морфологии разрушений и информационных технологий.
Материал и методы
Исследовали две группы материалов. В 1-ю группу вошли материалы судебно-медицинских экспертиз БУЗ ВО «Воронежское областное бюро судебно-медицинской экспертизы» за 2007—2017 гг.: заключения экспертов, акты судебно-медицинского исследования трупов — 1142 случая, из которых 452 (40%) случая с переломами длинных трубчатых костей.
Вторая группа — поврежденные длинные трубчатые кости трупов лиц, погибших в результате падения с высоты (83 перелома).
При исследовании материала 1-й группы регистрировали факт перелома длинной трубчатой кости, локализацию, плоскость разрушения и направление травмирующего воздействия относительно продольной оси длинной трубчатой кости при условии очевидности обстоятельств происшествия. При исследовании материалов 2-й группы изучали текстуру разрушения на всем протяжении излома (от зарождения до завершения разрушения) на сухих препаратах.
Возраст пострадавших составил от 20 до 60 лет, что соответствует однотипной механике разрушения кости со структурными свойствами хрупко-пластиночного типа [11, 12].
Для формирования структурного представления об особенностях демографической картины пострадавших и морфологии сформировавшихся повреждений использовали следующее:
1) ретроспективный анализ данных судебно-медицинской документации (документы практических судебно-медицинских экспертиз);
2) качественную оценку морфологии переломов длинных трубчатых костей путем остеоскопии и стереомикроскопии;
3) метод цифровой фотографии;
4) статистический анализ результатов сравнительной оценки морфологических признаков повреждений длинных трубчатых костей;
5) метод множественного линейного регрессионного анализа для прогностического моделирования варианта приземления и высоты падения.
Для структурирования изучаемого материала за основу взята классификация вариантов приземления [13] и диапазон высот падения от 3 до 81 м, структурированный пометражно по 10 м.
Результаты и обсуждение
Нарушение целостности длинных трубчатых костей в результате падения с высоты выявили у 47% погибших. При падении с высоты менее 10 м структурная доля составила 32% и достигла 96% при высоте падения более 50 м.
Из общей совокупности вариантов приземления доминируют вертикально-нижний — 21% (приземление на выпрямленные ноги) и горизонтально-задний — 40% (приземление на заднюю поверхность тела).
В результате комплексного изучения морфологических признаков повреждений длинных трубчатых костей установили, что продольное и поперечное направления внешней нагрузки вызывают переломы, различные по виду, локализации, траектории и текстуре разрушения.
При вертикально-нижнем и горизонтально-заднем вариантах приземления чаще происходят переломы бед-ренных (40%), большеберцовой (16%), плечевой (9%), малоберцовой (3%), локтевой (2%) и лучевой (1%) костей. При вертикально-нижнем варианте приземления переломы локализуются на уровне концевых отделов (58%) или (и) диафиза (42%), а при горизонтально-заднем — преимущественно на уровне диафиза (87%).

В случаях переломов концевых отделов длинных трубчатых костей при вертикально-нижнем приземлении траектория разрушения имеет косое направление. Такие переломы сопровождаются многооскольчатым разрушением эпифиза c выраженным смятием компактного и губчатого веществ.
Формирование диафизарных переломов костей нижних конечностей обусловлено сочетанием и конкурирующим взаимодействием трех видов деформации: «осевое сжатие», «продольный изгиб», «кручение» — и соответствующих типов разрушения костной ткани: разрыв, поперечный и продольный сдвиг. В таких условиях распределения напряжений чаще образуется фрагментарно-оскольчатое разрушение, распространяющееся не менее чем на 2/3 длины диафиза (рис.
1). Продольное направление ударной компрессии обусловливает «муфтообразное погружение» противоположных отломков, выступающие края которых контактируют, что приводит к формированию поверхностных сколов и смятию компактного вещества. Зона разрыва расположена поперечно относительно продольной оси.
На поверхности излома формируются участки вклинения в виде борозд вследствие выраженного осевого кручения. Зона сдвига характеризуется резким изменением траектории перелома. Устойчивые признаки — зигзагообразная траектория и пилообразный контур краев перелома данной области с образованием гребней и продольного расщепления на смежных или одной из поверхностей кости.
Деформация осевого сжатия служит источником для формирования множественных краевых сколов компактного вещества вершин зубцов. Траектория зоны долома расположена косо относительно оси, формируется на смежных поверхностях как верхней, так и нижней границы разрушения. Зона долома завершается пикообразными выступами, которые оказывают взаиморасклинивающее действие, приводящее к продольному расщеплению кости.
Выкрошивание компактного вещества и краевые сколы в зоне разрыва указывают на повторную травматизацию (дополнительное разрушение) вследствие взаимного скольжения отломков при перемещении тела на одну из поверхностей после первичного приземления на ноги.
Дальнейшее перемещение тела пострадавшего после приземления на ноги может привести к повторной травматизации в виде скола компактного вещества в зоне разрыва по типу «отщепа» (рис. 1).

При горизонтально-заднем варианте приземления морфологическая характеристика переломов длинных трубчатых костей отражает поперечное направление вектора ударной компрессии, распространяющейся навстречу падающему телу. Основными видами деформации являются слабовыраженный поперечный изгиб и последующие за ним поперечный и продольный сдвиги, конкурирующее действие которых проявляется в виде зигзагообразной траектории перелома на всем протяжении зоны сдвига (рис.
2). Зарождение разрушения бедренной кости расположено на передней поверхности, что связано с жесткой конструкцией прикрепления задней группы мышц бедра по шероховатой линии, препятствующей поперечному изгибу кости сзади по механизму разрушения двухопорной балки без консолей. В данном варианте разрушение начинается на передней поверхности кости, в нижней трети диафиза (здесь существенно меньше прочностные свойства диафизарной части кости) и распространяется к задней поверхности. Такое разрушение стержнеобразной конструкции цилиндрической формы протекает вопреки законам механики разрушения физически твердого тела с выраженными композитными свойствами строения. Оно происходит не по принципу нормального развития последовательно сменяющих друг друга напряжений костной ткани (растягивающие, касательные, сжимающие), а вследствие доминирования касательных напряжений сдвигового типа, вызывающих формирование оскольчатого разрушения в виде разностороннего треугольника.

При горизонтальных вариантах приземления диагностически значимым признаком поперечной нагрузки является формирование клювовидного выступа на границе зон разрыва и сдвига, за которым следует зигзагообразное разрушение диафиза вплоть до завершения разрушения — долома (рис. 3).
Для достоверности оценки результатов исследования провели математико-статистический анализ взаимосвязи качественных признаков повреждений, выступающих в роли зависимых результирующих показателей, и двух изучаемых характеристик кататравмы (вариант приземления и высота падения) методом множественного линейного регрессионного анализа. Набор исследованных параметров представлен значениями ранжированной шкалы признаков-повреждений длинных трубчатых костей, зафиксированных при исследовании погибших в результате кататравмы.
Дисперсионный анализ влияния многофакторной матрицы исследованных факторов на прогноз варианта приземления и высоты падения свидетельствует о статистически значимых различиях.
Коэффициенты прогнозирования высоты падения тела: менее 10 м — менее 2,0; от 10 до 20 м — 2,1—2,4; от 20 до 30 м — 2,41—3,0; от 30 до 40 м — 3,01—3,7; от 40 до 50 м — 3,71—3,9; 50 м и более — 4 и более. Коэффициенты прогнозирования варианта приземления тела: вертикально-верхний — менее 1,3; вертикально-нижний — 1,31—3,0; горизонтально-передний — 3,1—3,25; горизонтально-задний — 3,26—3,5; горизонтально-боковой — более 3,51.
Для оценки качества полученных прогностических моделей использовали построение ROC-кривой. Сама структура линейной зависимости и занимаемая ею площадь свидетельствуют о высоком качестве математических моделей прогнозирования варианта приземления (рис. 4)  и высоты падения (рис. 5).
и высоты падения (рис. 5). 
Заключение
1. Механогенез разрушения длинных трубчатых костей при падении с высоты зависит от варианта приземления тела и высоты падения, которые обусловливают формирование видоспецифических признаков повреждений костной ткани, связанных с локализацией приложения нагрузки.
2. Линейный регрессионный анализ позволяет выявить оптимальную совокупность морфологических признаков повреждений длинных трубчатых костей для определения варианта приземления и высоты падения, установить степень их информативности и диагностические коэффициенты.
3. Математическое моделирование повреждений в случае кататравмы методом линейного регрессионного анализа позволяет провести дифференциальную диагностику различных вариантов приземления тела и диапазонов высоты падения, что способствует научному обоснованию экспертных выводов и расширяет возможности объективной оценки механизмов травмы при падении с высоты.
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflicts of interest.
Источник: www.mediasphera.ru