Электронные сервисы Росздравнадзора, полезные в аптеке
Федеральная служба по надзору в сфере здравоохранения предоставляет через свой сайт несколько десятков сервисов для контроля обращения лекарственных средств и медицинских изделий. Многие из них станут хорошим подспорьем при работе в аптеке.
Проверка качества лекарственных препаратов
Эти сервисы позволяют искать информацию по названию, серии или производителю. Также присутствует функция расширенного поиска, позволяющая искать по нескольким критериям одновременно.
Также Росздравнадзор периодически публикует информационные письма с оперативной информацией по изменениям, касающимся конкретных лекарств.
Отслеживать их можно с помощью сервисов «Поиск писем по контролю качества лекарственных средств».
Проверка медицинских изделий
С помощью «Государственного реестра медицинских изделий и организаций (индивидуальных предпринимателей), осуществляющих производство и изготовление медицинских изделий» гораздо удобнее организовывать оборот данных товаров в аптеке. Приемочный контроль поступающих расходников и медицинских аппаратов должен включать в себя проверку сопроводительных документов и маркировки самих медизделий на соответствие данным государственного реестра.
Помимо этого, как и про лекарства, Росздравнадзор публикует информационные письма, касающиеся медицинских изделий. В них также приводятся свежие данные по безопасности. Следить за обновлениями поможет сервис «Информационные письма о медицинских изделиях».
Сервисы фармаконадзора
Обязанность по осуществлению фармаконадзора в отношении указанных групп аптечных товаров предусмотрена ФЗ № 323 «Об основах охраны здоровья граждан» и ФЗ № 61 «Об обращении лекарственных средств».
Данные о побочных реакциях на лекарственные препараты Росздравнадзор публикует в специальном подразделе «Мониторинг эффективности и безопасности лекарственных препаратов».
Правила фармаконадзора предусматривают также самостоятельную фиксацию поступивших жалоб в учетной системе Росздравнадзора или направлять в службу. Для передачи этих данных нужно пройти несложную регистрацию в автоматизированной системе «Фармаконадзор».
Подготовка к проверочным мероприятиям
В разделе «Контроль и надзор» Росздравнадзор размещает актуальные планы по ежегодному контролю субъектов фармацевтического рынка.
Попадание той или иной аптеки в план зависит от присвоенной ей категории риска, вычислить который можно самостоятельно с помощью электронного калькулятора, а затем проверить в реестре.
Также на своем сайте ведомство публикует «Перечень нормативных правовых актов (их отдельных положений)», нарушение которых может повлечь административную ответственность для аптечной организации.
Источник: www.medisorb.ru
Как проверить регистрационные удостоверения на медизделия: пошаговая инструкция
Обращение и реализация медицинских товаров возможны только при наличии регистрационного удостоверения. Оно выдается компетентными органами и подтверждает законность его использования на территории России.
Что такое регистрационное удостоверение на товар медицинского назначения (РУ)
Постановлением Правительства РФ от 27.12.2012 № 1416 утверждены правила государственной регистрации медицинских изделий. Документом, подтверждающим факт государственной регистрации, является РУ, которое выдается бессрочно. На территории Российской Федерации разрешается обращение только таких товаров, которые прошли государственную регистрацию. Регистрационное удостоверение на медизделие — это правоохранный документ, форма которого утверждена ПП № 1416.

В настоящее время оборот медизделий, не прошедших процедуру государственной регистрации, на территории Российской Федерации запрещена, за исключением строго определенных законом «Об основах охраны здоровья граждан в Российской Федерации» случаях. Например, продажа медпрепаратов без регистрационного удостоверения возможна, если они:
- ввезены на территорию РФ по жизненным показаниям конкретного пациента. Для ввоза такого препарата необходимо получать разрешение органа исполнительной власти, осуществляющего функции по контролю и надзору в сфере охраны здоровья;
- произведены в РФ для экспорта за пределы территории ЕАЭС, но не предназначены для применения на территории ЕАЭС;
- представляют собой укладки, наборы, комплекты и аптечки, состоящие из зарегистрированных изделий;
- предназначены для диагностики заболеваний и изготовлены в медицинской организации и применяются в организации, их изготовившей.
Исходя из системного анализа приведенной нормы, законодатель четко устанавливает, на какие изделия требуются регистрационные удостоверения в составе заявки на проведение торгов. Это все медицинские товары, не подпадающие под вышеперечисленный список.
Если организация закупает продукцию медицинского назначения, заказчик сможет проверить, зарегистрирован товар или нет, только с помощью специального удостоверения. Это официальное подтверждение того, что изделие является зарегистрированным в соответствии с действующим законодательством.
Таким образом, подтверждение госрегистрации демонстрирует только официальное РУ, которое легализует возможность реализации и обращения конкретных товаров в Российской Федерации.
Остались вопросы? Эксперты КонсультантПлюс разобрали, как получить регудостоверение на медизделие. Используйте эти инструкции бесплатно.

Чтобы прочитать, понадобится доступ в систему: ПОЛУЧИТЬ БЕСПЛАТНО НА 2 ДНЯ .
Когда необходимо требовать регистрационное удостоверение
Чтобы все закупаемые медицинские товары были надлежащего качества и соответствовали установленным требованиям, заказчику необходимо указать в закупочной документации условие о предоставлении соответствующего свидетельства. Действующая редакция 44-ФЗ позволяет заказчику включить требование к предоставлению регистрационного удостоверения на медицинское изделие в документацию о закупке.
Такая продукция входит в аукционный перечень в соответствии с РП РФ №471-р от 21.03.2016, следовательно, ее надлежит закупать путем электронного аукциона.
Закупочной комиссии надлежит внимательно изучить РУ на закупаемые товары на предмет сложной части, то есть проверить, входит ли конкретное закупаемое медицинское изделие в совокупность предметов, зарегистрированных в составе РУ. Если все данные совпадают, то заявка признается соответствующей требованиям закупочной документации. Если нет, то такой запрос необходимо отклонить.
Обязательством поставщика является передача заказчику товара вместе со всей относящейся к нему документацией (сертификат соответствия, техпаспорт, инструкция, свидетельство о регистрации (п. 2 ст. 456 ГК РФ). Чтобы проверить предоставленные регистрационные удостоверения, организация-заказчик вправе требовать их копии как в составе заявки, так и в дальнейшем, при поставке и приемке товара.
Как проверять регистрационные удостоверения
Закупочная комиссия вправе провести проверку РУ, так как рассматриваются только те, которые действительны на момент проведения закупки.
Также участник закупки не вправе предоставлять РУ с истекшим сроком действия, так как оно признается недействительным. Вопрос о сроках действия РУ достаточно актуален и часто возникает при проведении закупки. Чтобы не допустить ошибок, обратитесь к реестру медицинских изделий (ГРМИ). Это ресурс , где смотрят срок действия регистрационного удостоверения на медицинское изделие. На сегодняшний день РУ выдается бессрочно, но для РУ, выданных по старым правилам, устанавливается конкретный срок.
Для проверки того или иного РУ используйте официальный сайт Росздравнадзора. ГРМИ представляет собой базу, содержащую расширенные сведения о медицинской продукции и ее производителях. Несмотря на то, что в сети есть достаточно много ресурсов, предоставляющих возможность проверки РУ, рекомендуется использовать этот сайт. Это связано с тем, что Росздравнадзор проводит постоянный мониторинг и актуализацию информации, содержащейся на ресурсе.
Как и что проверять заказчику в регистрационном удостоверении, расскажем в приведенной инструкции:
1. На сайте Росздравнадзора в поисковой строке вводим наименование интересующего нас товара.
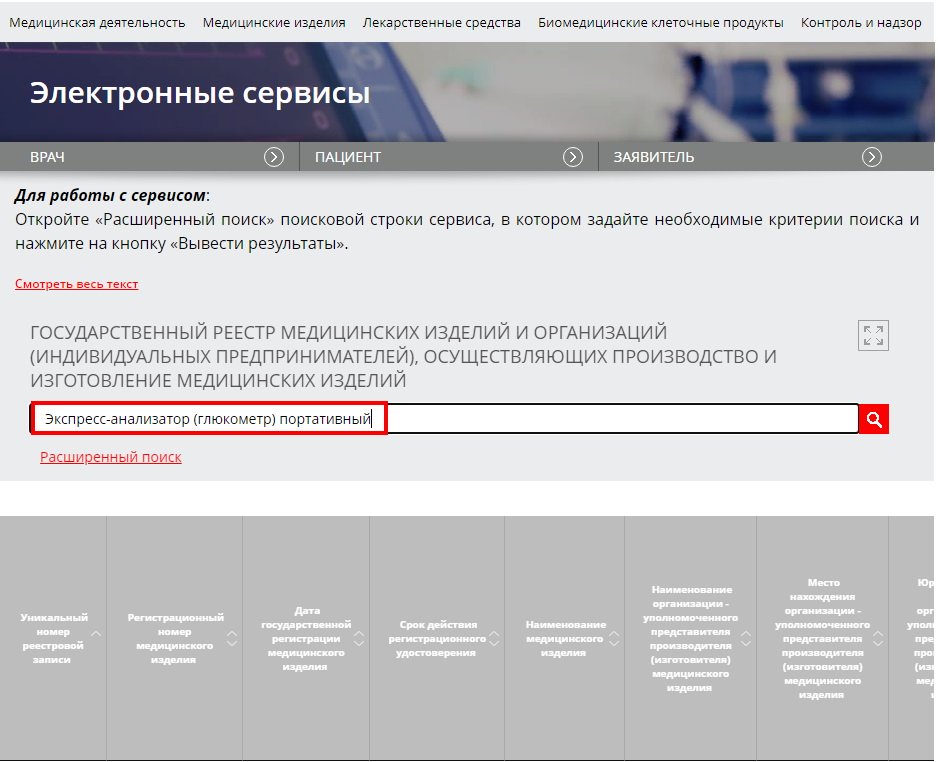
2. Из перечня выбираем интересующую нас позицию.
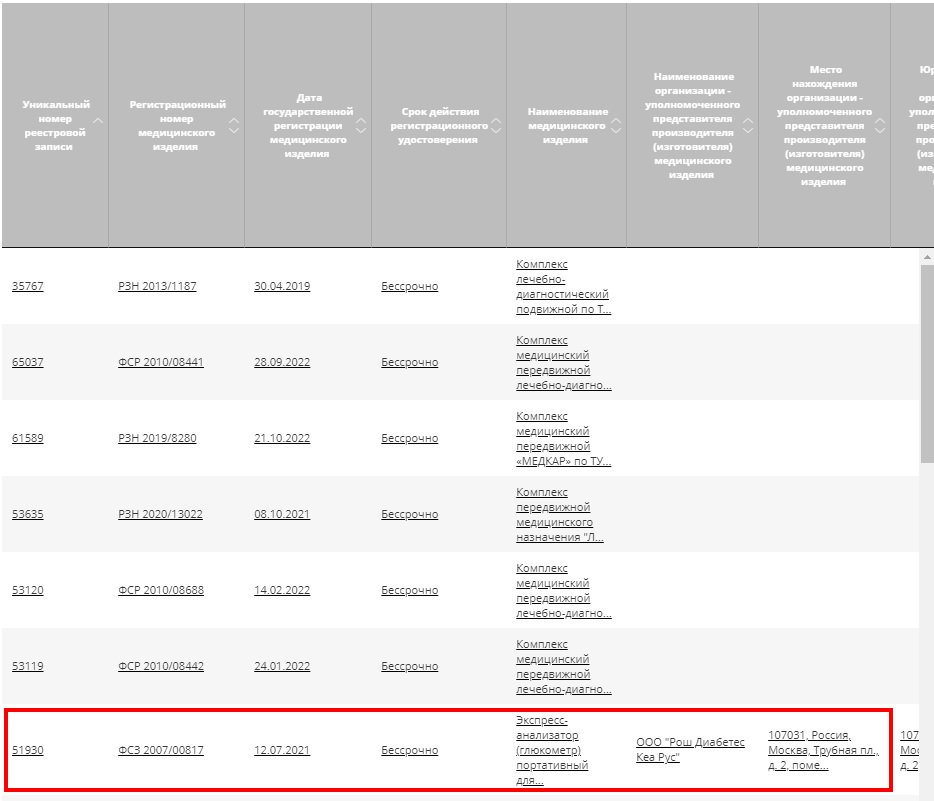
3. На странице реестровой записи скачиваем РУ.
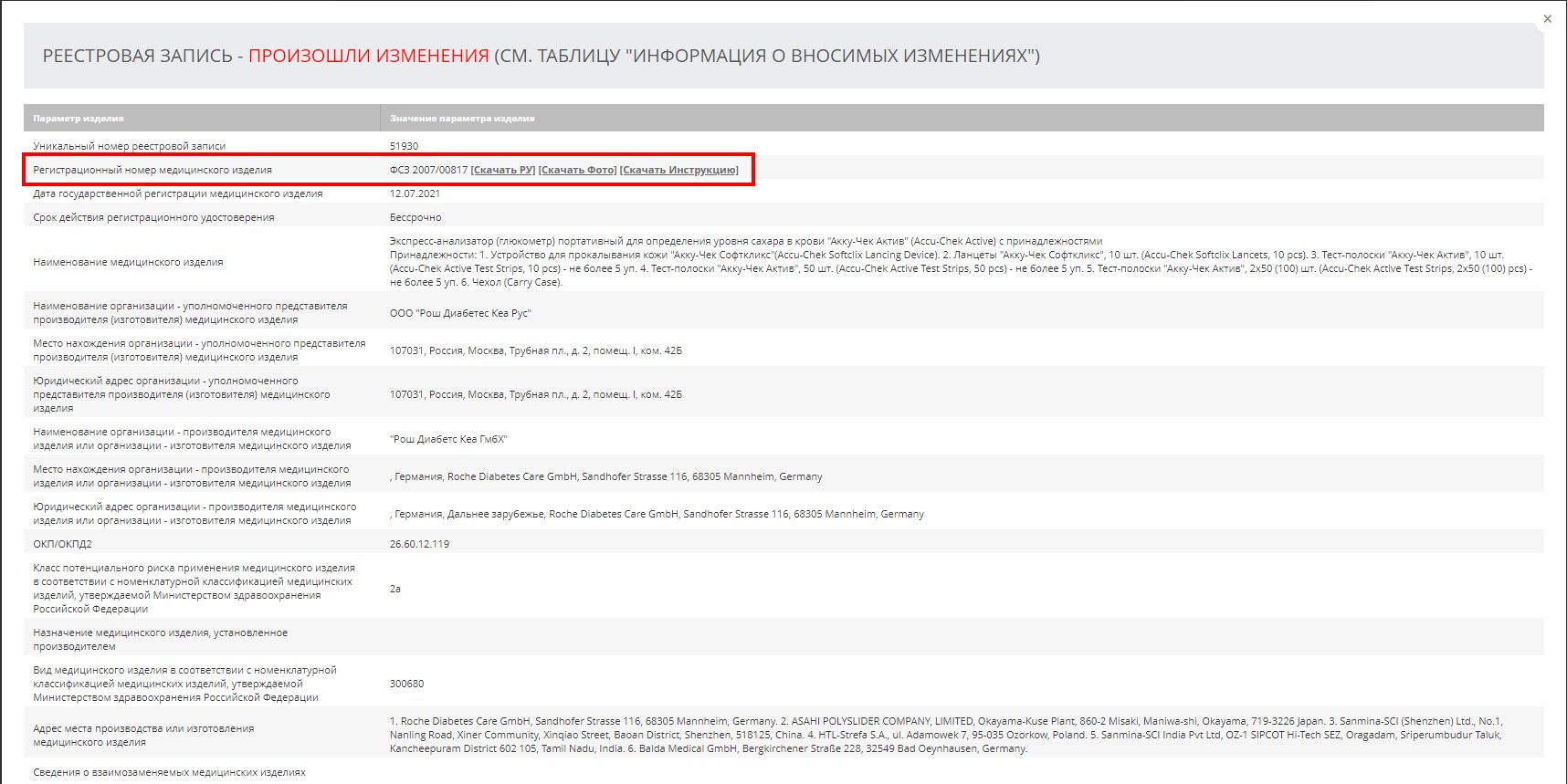

4. Из содержания документа узнаем:
- наименование товара;
- производителя;
- кому выдано РУ;
- комплектацию.
При проведении закупок мед. препаратов нередко возникает вопрос: должно ли соответствовать название медицинского изделия названию из регистрационного удостоверения. Определенно — да. Маркировка — это данные, которые предоставляются разработчиком и которые связаны с данным изделием медназначения. Они прикрепляются к продукции либо размещаются на ее упаковке. На упаковке необходимо указывать следующие данные:
- о производителе;
- номер РУ и дату его выдачи;
- о назначении, о методе и способах применения,
- об эффективности действия и возможных противопоказаниях.
Данные в сопроводительных, в том числе и рекламных, материалах должны совпадать с данными, указанными в регистрационных удостоверениях. При проведении закупки как заказчики, так и поставщики должны проверять соответствие этих данных. Для этих целей ресурс Росздравнадзора предоставляет возможность воспользоваться расширенным поиском.
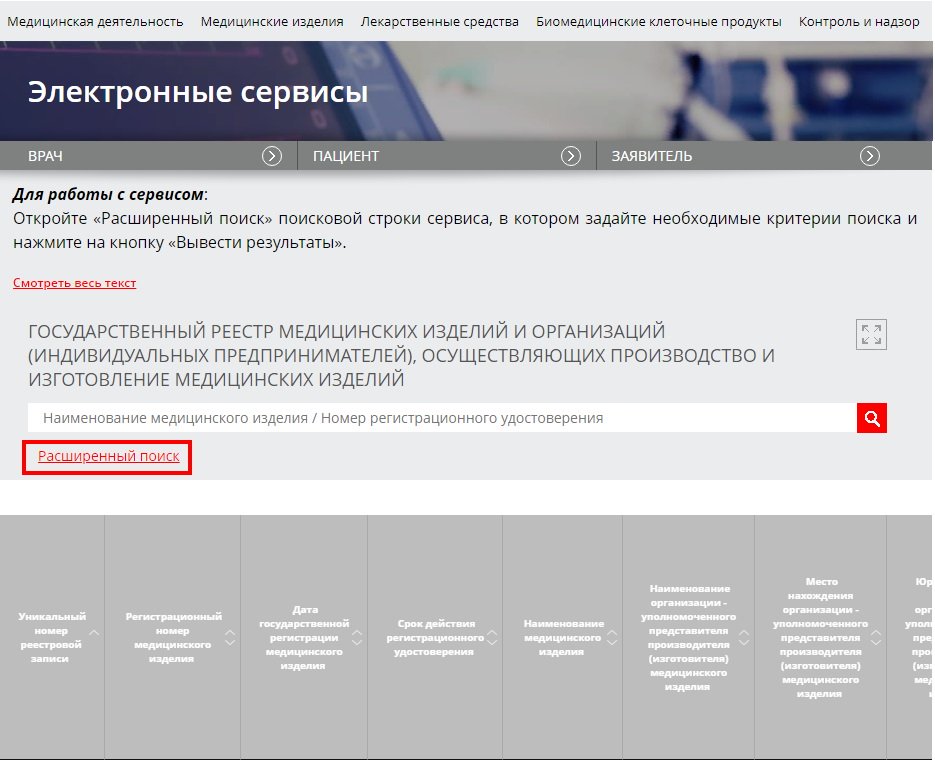
Он пригодится, если необходимо найти позицию по конкретным характеристикам.
Открываете таблицу поиска, где указываете регистрационное удостоверение на медицинское изделие либо иные параметры для поиска.
- особенности закупок медоборудования, медизделий и расходных материалов;
- закупаем лекарственные средства.
Источник: goscontract.info
Какие документы нужны для регистрации медицинского изделия
По закону на российском рынке свободно продавать можно только те медицинские товары, которые прошли обязательную государственную регистрацию (ст.38 ФЗ от 21 ноября 2011 года N 323-ФЗ). Факт ее прохождения подтверждается выдачей регистрационного удостоверения (РУ). Как его получить?


По закону на российском рынке свободно продавать можно только те медицинские товары, которые прошли обязательную государственную регистрацию (ст.38 ФЗ от 21 ноября 2011 года N 323-ФЗ). Факт ее прохождения подтверждается выдачей регистрационного удостоверения (РУ). Чтобы получить его, заявитель обязан пройти сложную многоступенчатую процедуру.
Из чего состоит процедура госрегистрации
Рассмотрением регистрационных заявок и оформлением регистрационных удостоверений в нашей стране занимается Росздравнадзор. Алгоритм госрегистрации может несколько варьироваться в зависимости от того, к какому классу потенциального риска применения относится регистрируемый медицинских товар.
Однако для большей части продуктов краткое описание этой процедуры будет выглядеть так.
- Заявитель проводит обязательные испытания товара, включая токсикологические и технические, оформляет отчеты по результатам испытаний и собирает другие документы, входящие в состав регистрационного досье.
- Регистрационное досье подается в Росздравнадзор для рассмотрения.
- Росздравнадзор проверяет поданный пакет, и, если комплект документации не содержит ошибок в части оформления и содержания, ведомство назначает выполнение I этапа экспертизы качества, действенности и безопасности товара.
- Уполномоченная экспертная организация выполняет I этап экспертизы, который предполагает содержательный анализ сведений, содержащихся в документах регистрационного пакета. Выводы о характеристиках продукта и целесообразности продолжения процедуры госрегистрации оформляются в виде экспертного заключения, которое передается в Росздравнадзор.
- Сотрудники ведомства знакомятся с выводами, содержащимися в экспертном заключения, и, если рекомендации специалистов оказываются положительными, назначают выполнение клинических испытаний.
- Аккредитованная медицинская организация проводит клинические испытания и оформляет их результаты протоколом установленного образца, который передается в Росздравнадзор.
- Сотрудники ведомства знакомятся с протоколами и, если результаты испытаний подтверждают действенность и безопасность продукта для человека, назначают проведение II этапа экспертизы.
- Уполномоченная экспертная организация выполняет II этап экспертизы, в рамках которого изучаются данные, полученные в процессе проведения клинических испытаний. Результаты изучения документации оформляются в виде экспертного заключения, которое снова передается в Росздравнадзор.
- Сотрудники ведомства изучают последнее экспертное заключение и делают окончательный вывод о возможности госрегистрации товара. Если этот вывод будет положительным, они оформляют регистрационное удостоверение, передают его заявителю и вносят запись о регистрации в Единый реестр зарегистрированных медицинских товаров, опубликованный на сайте ведомства. Удостоверение не имеет ограничений по сроку действия.
Исключение — товары, которые принадлежат к 1 классу риска потенциального применения, то есть несут наименьшую опасность для пациентов. Они проходят клинические испытания еще до начала регистрации, то есть на этапе составления регистрационного досье. Благодаря этому для них не проводится I этап экспертизы и клинические испытания после него: изучив регистрационное досье, Росздравнадзор сразу назначает выполнение II этапа экспертизы.
При этом во всех ситуациях общая длительность процедуры регистрации не должна превышать 50 рабочих дней. Однако в этот срок не включается период выполнения клинических испытаний, которые могут занять разное время в зависимости от сложности и возможных рисков, связанных с применением медицинского товара по назначению.
Заявление о госрегистрации
Основанием для начала регистрационной процедуры становится получение Росздравнадзором заявления от соискателя, который хотел бы получить РУ. Свободная форма его составления не предполагается: состав сведений, которые должны быть отражены в этом документе, однозначно регламентированы пунктом 9 постановления № 1416. В их число входят:
- название медицинского продукта и принадлежностей, которые необходимы для его использования по назначению. Если для его идентификации применяют товарный знак или другие дополнительные средства, эта информация также должна быть указана в заявлении;
- полное и сокращенное название компании-разработчика, организационно-правовая форма компании, адрес ее места расположения и контактные данные – телефон и электронная почта. Аналогичные сведения указываются в случае, если заявителем выступает индивидуальный предприниматель, только в этой ситуации вместо названия организации и ее правовой формы приводятся фамилия, имя и отчество ИП, а также реквизиты документы, удостоверяющего его личность;
- те же данные о компании-изготовителе товара;
- те же данные об уполномоченном представителе производителя, если такой имеется;
- те же данные о заявителе, обращающемся за выдачей регистрационного удостоверения;
- место изготовления товара;
- назначение продукта, определенное производителем;
- вид товара в соответствии с номенклатурной классификацией, приведенной в приказе Минздрава от 6 июня 2012 года N 4н;
- класс потенциального риска применения продукта, определенный согласно приказу № 4н;
- код товара в соответствии с общероссийским классификатором ОК 034-2014 (КПЕС 2008);
- предпочитаемый метод получения регистрационного удостоверения – в бумажном или электронном виде.
К заявлению соискатель обязан приложить список документов, подтверждающий соответствие продукта, предоставляемого на регистрацию, установленным требованиям.
Регистрация медицинских изделий: перечень документов
Состав пакета документов, прикладываемых к заявлению, включает следующие позиции;
- копия документа, подтверждающего полномочия заявителя;
- информация о действующих нормативных документах дляэтого типа медицинского продукта;
- техническая и эксплуатационная документация производителя на товар, включая инструкцию по эксплуатации или руководство по применению;
- фотографии самого товара и принадлежностей, необходимых для его применения по назначению, размером не меньше 18*24 см;
- документация, содержащая данные о результатах выполненных испытаний, включая технические, токсикологические, клинические (для товаров 1 класса риска) и испытания в целях утверждения типа (если это требуется для этой категории продукта);
- проект плана выполнения клинических испытаний с учетом характера товара (для продуктов, принадлежащих к классам риска 2а, 2б и 3);
- опись документации, прикладываемой к заявлению.
Для отдельных типов товаров могут потребоваться дополнительные документы.
Например, если товар выпущен за рубежом и в установленном порядке ввезен в Россию в целях выполнения его государственной регистрации, нужно будет предоставить разрешение на ввоз продукта, выданное уполномоченным органом. Также в этой ситуации заявителю нужно предоставить документы, выданные в стране производства в целях подтверждения качества, действенности и безопасности самого медизделия или компонентов, сырья, материалов и других объектов, использованных при его изготовлении. Если такие документы оформлены на иностранном языке, они должны быть переведены на русский.
Этот список документации будет исчерпывающим. Регистрирующий орган не вправе требовать от заявителя предоставить другие документы — например, журнал регистрации использования изделий медицинского назначения. Если по каким-то причинам процедура госрегистрации будет прервана, документы для возобновления регистрации медицинского изделия придется собрать заново по первоначальному списку.
Источник: www.klerk.ru